McMaster-Verfahren
- zur quantitativen Bestimmung der Strongylideneier pro Gramm Kot (EpG)
- erst ab einem international anerkannten Grenzwert von 200 EpG wird entwurmt
- auch Spulwurmeier werden bei dieser Methode entdeckt
- für Bandwurmeier nur bedingt geeignet
- Kotmenge mindestens 10 - 20g
Wir verwenden für die Methode 8g Kot und 40ml Wasser im Ansatz. Außerdem zählen wir 2 McMaster-Kammern pro Pferd aus, somit liegt die untere Nachweisgrenze des Verfahrens bei 20 EpG (Eiern pro Gramm Kot). Als Flotationslösung verwenden wir eine gesättigte Kochsalzlösung.


Kombinierte Sedimentation-Flotation
- Nachweis von Strongyliden-, Spulwurm- und Bandwurmeiern
- sicherste Methode Bandwurmeier nachzuweisen
- aus einer 3 Tage Sammelkotprobe
- Kotmenge pro Tag ca. 20g einsammeln
Wir verwenden für den Ansatz 40-42g Kot und ca. 500ml Wasser. Die so aufbereiteten Proben bleiben 12h im Kühlschrank zur Sedimentation stehen. Hierbei sinken die Wurmeier mit dem Sediment ab. Nach 12h+ wird das überstehende Wasser abgegossen und das Sediment in 2 Reagenzgläser verteilt. Diese werden im Anschluß zentrifugiert. Das überstehende Wasser wird erneut abgeschüttet und das Sediment im darauffolgenden Schritt im ersten Reagenzglas mit gesättigter Kochsalzlösung (Dichte 1,2) und im zweiten Reagenzglas mit gesättigter Glucoselösung (Dichte 2) vermischt und mit einem Deckgläschen verschlossen, auf welchem sich die aufsteigenden Wurmeier sammeln lassen. Dieser Ansatz bleibt dann nochmal 1 Stunde stehen, bevor es ein letztes Mal vor der Auswertung in die Zentrifuge geht.
Nachweis "Großer Strongyliden"
Momentan bieten wir nur die Larvenanzucht auf Große Strongyliden an. Hierbei werden aus den vorhandenen Eiern im Kot über 14-21 Tage im Labor die Larven ausgebrütet. Mit Hilfe des Trichterauswanderungsverfahrens werden die Larven dann aus dem Kot geholt und unter dem Mikroskop beurteilt, ob es sich um Kleine oder Große Strongyliden handelt.
Die PCR Methode zum Nachweis der 4 verschiedenen Großen Strongylidenarten beim Pferd können wir hoffentlich für alle Kunden ab September 2025 anbieten. Diese Probe werden wir in einem externen Labor von PCR-Spezialisten durchführen lassen.
Vorteil der PCR-Methode ist eine höhere Genauigkeit, da die Eier sich nicht erst zu Larven entwickeln müssen, um gefunden zu werden.
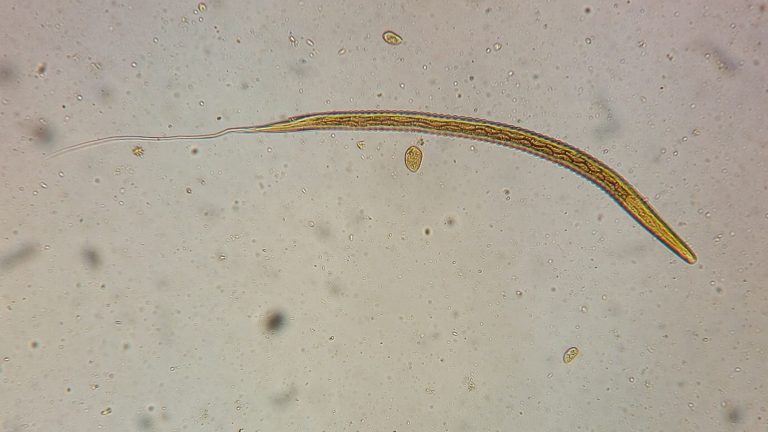

Klebstreifen-Abklatsch
Zur Untersuchung auf Oxyuren wird ein sogenannter Abklatsch verwendet. Oxyuren kann man nicht in der Kotprobe feststellen (nur in seltenen Außnahmen).
Man nimmt dazu einen zeigefingerlangen, schmalen Streifen Tesafilm und drückt die Mitte des Streifens an die Haut um den Anus des Pferdes. Wenn sie dort weiße oder gelbliche Ablagerungen sehen, dann bitte genau auf diese Stellen. Danach überführen sie den Klebstreifen auf einen Objektträger oder einen Gefrierbeutel (klar und durchsichtig). Jetzt befinden sich die Oxyureneier zwischen dem Klebstreifen und dem Träger und können von uns unter dem Mikroskop untersucht werden. Hierzu muss der Träger aber klar und durchsichtig sein, ansonsten ist es uns nicht möglich, die kleinen, nur durch ihre Kontur hervorgehobenen Eier unter dem Mikroskop zu erkennen.
©Dr. Sabine Paul. Alle Rechte vorbehalten.
Wir benötigen Ihre Zustimmung zum Laden der Übersetzungen
Wir nutzen einen Drittanbieter-Service, um den Inhalt der Website zu übersetzen, der möglicherweise Daten über Ihre Aktivitäten sammelt. Bitte überprüfen Sie die Details in der Datenschutzerklärung und akzeptieren Sie den Dienst, um die Übersetzungen zu sehen.
